现代生物化学第三版黄熙泰pdf完整免费版|百度网盘下载
编者注:黄希泰,现代生物化学第三版
《现代生物化学》第三版在第二版的基础上进行了重大修改和增删,完善了制度,更新了内容,以适应学科发展和教学的需要。本书体系完整,表述清晰。每章都附有思考题。欢迎有需要的朋友下载学习

简介
现代生物化学第三版
《现代生物化学》(第2版)自2005年出版以来,以其内容简洁新颖、概念准确、功能齐全而备受赞誉。
一般欢迎学生。 2006年被教育部评为“十一五”期间普通高等教育国家级规划教材。 《现代生物化学》No.
在第二版的基础上,进行了重大修改、增删,完善了制度,更新了内容,以适应学科发展和教学的需要。
本书体系完整,表述清晰。每章都附有思考题。书末附有中英文对照及生化关键术语索引。适用于生物学
可作为农、林、医、医、工等各专业及相关专业本科生、研究生的教学用书,也可作为科学研究的参考书。
相关内容部分预览


生物化学完整版的注意事项!
第一章介绍
1、生物化学的概念:
生物化学是一门利用化学原理和方法探索生命的科学。它是化学、生物学和物理学之间的边缘学科。
2、生物化学的发展:
1、描述生化阶段:是生化发育的胚胎阶段,其主要工作是分析和研究生物的组成和生物的分泌物和排泄物。
2、动态生化阶段:是生化蓬勃发展的时期。这一时期,人们基本弄清楚了生物体内各种主要化学物质的代谢途径。
3、分子生物学阶段:该阶段的主要研究工作是探索各种生物大分子的结构与其功能之间的关系。
3、生化研究的主要方面:
1、生物的物质组成:高等生物主要由蛋白质、核酸、碳水化合物、脂类、水、无机盐等组成,还含有一些低分子物质。
2、物质代谢:物质代谢的基本过程主要包括消化、吸收→中间代谢→排泄三个步骤。其中,中间代谢过程是在细胞内进行的,是最复杂的化学变化过程,包括合成代谢、分解代谢、物质相互转化、代谢调节和能量代谢。
3、细胞信号转导:细胞中存在多条信号转导通路,这些通路以一定的方式相互交织,从而形成一个非常复杂的信号转导网络,调节细胞分化的代谢、生理活动和生长。
4、生物大分子的结构与功能:通过对生物大分子结构的了解,揭示结构与功能的关系。
5、遗传与繁殖:生物体遗传与繁殖的分子机制研究也是现代生物化学和分子生物学研究的重要组成部分。
第二章蛋白质结构与功能
1、氨基酸:
1、结构特征:氨基酸是蛋白质分子的基本组成部分。构成天然蛋白质分子的氨基酸约有20种。除了脯氨酸是α-亚氨基酸,甘氨酸是不含手性碳原子的,其余的氨基酸都是L-α-氨基酸。
2、分类:氨基酸按R组氨基酸的极性可分为四类:①非极性中性氨基酸(8种); ②极性中性氨基酸(7种); ③酸性氨基酸(Glu和Asp)); ④碱性氨基酸(Lys、Arg和His)。
2、肽键和肽链:
肽键是指一分子氨基酸的α-羧基与另一分子氨基酸的α-氨基脱水形成的共价键(-CO-NH-)。参与肽键形成后,氨基酸分子因脱水而结构不完整,称为氨基酸残基。
每条多肽链都有两个末端:游离氨基末端(N末端)和游离羧基末端(C末端)。肽链的方向是N末端→C末端。
3、肽键平面(peptide unit):
肽键具有部分双键的性质,不能自由旋转;构成肽键的四个原子与其相邻的两个α碳原子在同一平面上,为刚性平面结构,称为肽键平面。
4、蛋白质分子结构:
蛋白质的分子结构可以人为地分为一级、二级、三级和四级结构。一级结构是线性结构,二级、三级和四级结构是空间结构。
1、一级结构:指多肽链中氨基酸的排列方式,其维持键为肽键。蛋白质的一级结构决定了它的空间结构。
2、二级结构:是指多肽链骨架卷曲折叠形成的构象,由氢键维持。主要有以下几种:
(1)α-螺旋:其结构特点是:①主链的主链围绕中心轴盘绕形成右旋螺旋; ②螺旋的每个上翘是3.6个氨基酸残基,螺距为0.54 nm; ③相邻螺旋圈之间形成许多氢键; ④侧链基团位于螺旋外侧。
影响α-螺旋形成的主要因素有:①存在较大侧链基团的氨基酸残基; ② 存在带相同电荷的连续氨基酸残基; ③脯氨酸残基的存在。
2 β-折叠:其结构特点是:①若干肽链或肽段排列成平行或反平行的折叠; ②所有肽键的C=O和N-H形成链间氢键; ③侧链基团簇交替位于片层的上方和下方。
CDβ-转角:多肽链的180°转角部分通常由四个氨基酸残基组成,通过残基1和4之间形成氢键来维持。
⑷随机盘绕:主链骨架部分不规则盘绕。
3、三级结构:指多肽链中所有原子的空间排列。主要键为非共价键(二级键):氢键、疏水键、范德华力、离子键等,也可能涉及二硫键。
4、四级结构:指亚基之间的三维排列、接触位点的布局等,维持键为非共价键。亚基是指参与蛋白质四级结构并具有独立三级结构的多肽链。
V。蛋白质的理化性质:
1、两性解离和等电点:蛋白质分子中仍有游离氨基和游离羧基,因此蛋白质具有与氨基酸相同的两性解离性质。当蛋白质分子的正负电荷相等时溶液的pH值称为蛋白质的等电点。
2、蛋白质的胶体性质:蛋白质具有亲水性溶胶的性质。蛋白质分子表面的水合膜和表面电荷是稳定蛋白质亲水溶胶的两个重要因素。
3、蛋白质的紫外吸收:蛋白质分子中的色氨酸、酪氨酸和苯丙氨酸残基吸收紫外光,色氨酸吸收最强,最大吸收峰为280nm。
4、蛋白质变性:在某些理化因素的作用下,蛋白质的特定空间结构被破坏,导致其理化性质发生变化,失去生物活性。这种现象称为蛋白质变性。引起蛋白质变性的因素包括:高温、高压、电离辐射、超声波、
紫外线和有机溶剂、重金属盐、强酸强碱等。大多数蛋白质分子的变性是不可逆的。
6、蛋白质的分离纯化:
1、盐析和有机溶剂沉淀:在蛋白质溶液中加入大量中性盐,破坏蛋白质的胶体性质,使蛋白质从溶液中沉淀出来,称为盐析。常用的中性盐有:硫酸铵、氯化钠、硫酸钠等。盐析时,溶液的pH值在蛋白质的等电点时效果最好。
任何能与水以任意比例混合的有机溶剂,如乙醇、甲醇、丙酮等,都会引起蛋白质沉淀。
2、电泳:蛋白质分子在溶液中携带高于或低于其 pI 的净负电荷或正电荷,因此可以在电场中移动。电泳迁移率的大小主要取决于蛋白质分子的电荷量和分子大小。
3、透析:利用透析袋膜的超滤特性,可将大分子物质与小分子物质分离。
4、色谱法:利用混合物中各组分物理化学性质的差异,使相互接触的两相(固定相和流动相)之间的分布不同,进行分离。主要有离子交换层析、凝胶层析、吸附层析和亲和层析,其中凝胶层析可用于测定蛋白质的分子量。
5、超速离心:利用物料密度的差异,超速离心后分布在不同的液层中,进行分离。超速离心也可用于测定蛋白质的分子量,其与沉降系数S成正比。
7、氨基酸序列分析:
蛋白质多肽链的氨基酸序列分析,即蛋白质一级结构的确定,主要包括以下步骤:
1、对蛋白质进行分离纯化,得到一定量的纯蛋白质;
2、取一定量的样品进行完全水解,然后测定蛋白质的氨基酸组成;
3、蛋白质N端和C端氨基酸分析;
4、使用特定的酶(如糜蛋白酶)或化学试剂(如溴化氰)将蛋白质加工成若干肽片段;
5、单肽的分离纯化;
6、确定每个肽的氨基酸序列。一般采用Edman降解法与异硫氰酸苯酯反应,将氨基酸降解后逐一测定;
7、用至少两种不同的方法处理蛋白质以获得其肽段的氨基酸序列;
8、比较两组不同肽段的氨基酸序列,得到完整蛋白质分子的氨基酸序列。
第三章核酸的结构和功能
1、核酸化学成分:
1、含氮碱基:参与形成核酸和核苷酸的含氮碱基主要分为嘌呤碱基和嘧啶碱基两大类。构成核苷酸的主要嘧啶碱基有三种——尿嘧啶(U)、胞嘧啶(C)和胸腺嘧啶(T),它们都是嘧啶的衍生物。
构成核苷酸的主要嘌呤碱基有两种——腺嘌呤 (A) 和鸟嘌呤 (G),它们都是嘌呤的衍生物。
2、戊糖:核苷酸中有两种主要的戊糖,即β-D-核糖和β-D-2-脱氧核糖。由此形成的核苷酸又分为核糖核苷酸和脱氧核糖核酸。类别。
3、核苷:核苷是由戊糖和含氮碱基脱水缩合形成的化合物。通常,核糖或脱氧核糖的C1'β-羟基与嘧啶碱基N1或嘌呤碱基N9缩合,因此产生的化学键称为β,N糖苷键。其中,D-核糖的产生者称为核糖核苷,
而由脱氧核糖产生的称为脱氧核糖核苷。由“稀有碱基”产生的核苷称为“稀有核苷”。假尿苷 (ψ) 是一种核苷,由 D-核糖的 C1' 与尿嘧啶的 C5 连接而成。
2、核苷酸的结构和命名:
核苷酸是由核苷和磷酸脱水缩合形成的磷酸盐化合物,包括核糖核苷酸和脱氧核糖核酸。最常见的核苷酸是 5'-核苷酸(通常省略 5')。 5'-核苷酸按5'位缩合的磷酸基团数目可分为单磷酸核苷(核苷酸)、二磷酸核苷和三磷酸核苷。
此外,生物体内还有一些特殊的环核苷酸,常见的有环磷酸腺苷(cAMP)和环磷酸鸟苷(cGMP),它们通常是激素作用的第二信使。
核苷酸通常使用缩写命名。第一个符号是小写d的deoxy,第二个是大写字母的碱基,第三个是大写字母的磷酸基团数,第四个是大写字母P的磷酸。
3、核酸的一级结构:
核苷酸通过3'、5'-磷酸二酯键连接形成多核苷酸长链化合物,没有侧链,称为核酸。核酸具有方向性,5'-位带有游离磷酸基的末端称为5'-末端,3'-位带有游离羟基的末端称为3'-末端。
DNA 由四种脱氧核糖核苷酸组成,即 dAMP、dGMP、dCMP 和 dTMP。 DNA的一级结构是指DNA分子中脱氧核糖核苷酸的种类、数量、排列和连接方式。 RNA由四种核糖核苷酸组成:AMP、GMP、CMP和UMP。
RNA的一级结构是指RNA分子中核糖核苷酸的类型、数量、排列和连接。
4、 DNA的二级结构:
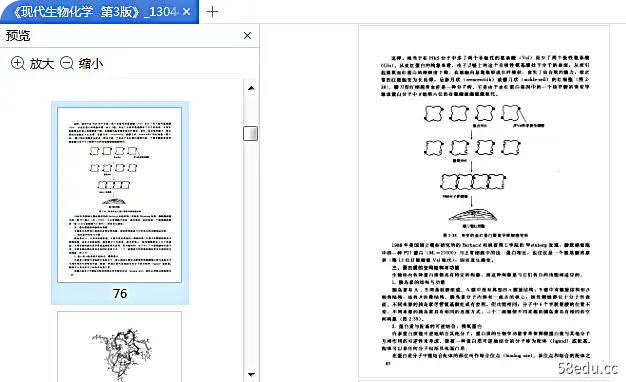
DNA双螺旋结构是DNA二级结构的一种重要形式。它是沃森和克里克在1953年提出的一种结构模型。主要的实验依据是查格夫课题组的DNA化学成分。进行的分析研究,
即DNA分子中四个碱基的摩尔百分比分别为A=T、G=C、A+G=T+C(Chargaff原理),分析DNA晶体X射线衍射图由威尔金斯研究小组完成。
天然DNA的二级结构主要为B型,其结构特点是:①为右旋双螺旋,两条链反平行排列; ② 主链位于螺旋外侧,碱基位于内侧; ③ 两条链之间存在碱基互补,通过氢键连接,A-T、G-C(碱基互补原理);
④螺旋的稳定因素是氢键和碱基堆积力; ⑤螺旋的节距为3.4nm,直径为2nm。
V。 DNA的超螺旋结构:
双螺旋DNA分子进一步盘绕形成的超螺旋结构称为DNA的三级结构。
大多数原核生物的 DNA 是共价闭合的环状双螺旋结构,具有类似扭曲的三级结构。
在真核生物中,双螺旋 DNA 分子盘绕在蛋白质八聚体周围,形成称为核小体的特殊珠状结构。核小体结构属于DNA的三级结构。
6、 DNA的功能:
DNA的基本功能是作为遗传信息的载体,为生物遗传信息的复制和遗传信息的转录提供模板。
具有特定生物学功能的 DNA 分子片段称为基因。生物体的整个 DNA 序列称为基因组。基因组的大小与生物体的复杂性有关。
7、 RNA的空间结构和功能:
RNA分子种类繁多,分子大小变化大,功能多样。 RNA通常以单链形式存在,但也可以形成部分双螺旋结构。
1、 mRNA的结构和功能:mRNA是一种单链核酸,其在真核生物中的主要产物称为HnRNA。大多数真核成熟 mRNA 分子具有典型的 5'-末端 7-甲基鸟苷三磷酸 (m7GTP) 帽结构和 3'-末端聚腺苷酸 (polyA) 尾结构。
mRNA的功能是为蛋白质合成提供模板,分子携带遗传密码。 mRNA分子中每三个相邻的核苷酸组成一个基团,在蛋白质翻译和合成过程中代表一个特定的氨基酸。这个核苷酸三联体被称为遗传密码(coden)。
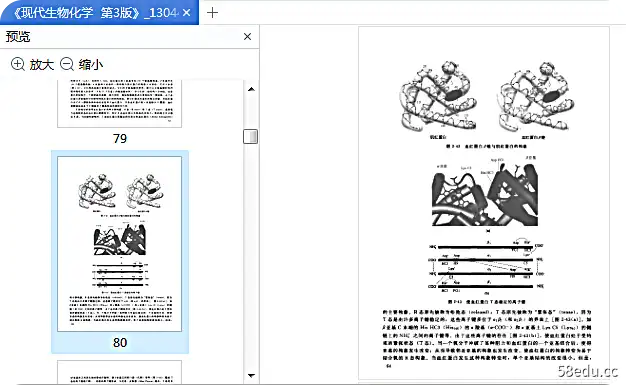
2、 tRNA的结构和功能:tRNA是最小的分子,但含有最稀有的碱基。 tRNA的二级结构因局部形成双螺旋而呈现“三叶草”状,故称为“三叶草”结构,可分为五部分: ①氨基酸臂:由5'-组成tRNA 的末端和 3' p> 由
-末端,3'-末端有-CCA-OH序列,可与氨基酸结合携带氨基酸。 ②DHU臂:含有二氢尿苷,与氨酰tRNA合成酶结合有关。 ③反密码子臂:反密码子环中间的三个核苷酸组成一个三联体,
在蛋白质生物合成中,可用于识别mRNA上的相应密码,故称为anticoden。 ④ TψC arm:含有保守的TψC序列,可识别核糖体蛋白上的rRNA,促进tRNA与核糖体结合。 ⑤变量臂:位于TψC臂和反加密臂之间,功能未知。
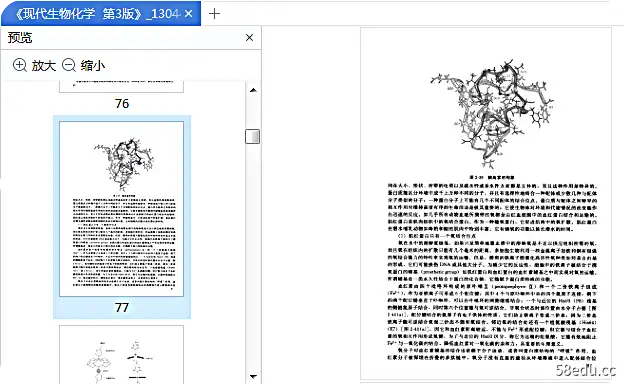
3、 rRNA的结构和功能:rRNA是细胞中含量最多的RNA,它可以与蛋白质一起形成核糖体,作为蛋白质生物合成的场所。原核生物中存在三种类型的 rRNA:5S、16S 和 23S。真核生物中有四种类型的 rRNA:5S、5.8S、18S 和 28S。
8、核酶:
具有自催化功能的 RNA 称为核酶。核酶通常具有特殊的分子结构,例如锤头结构。
九。核酸的一般理化性质:
核酸有酸性;高粘度;能吸收紫外线,最大吸收峰为260nm。
X。 DNA变性:
在物理和化学因素的作用下,DNA双螺旋的两条互补链松开,分离成单链,导致DNA的物理、化学和生物学性质发生变化。这种现象称为 DNA 变性。
引起DNA变性的主要因素有:①高温,②强酸强碱,③有机溶剂等。变性后DNA性质的变化:①增色作用:指吸光度DNA变性后260nm紫外光增加; ②旋光性降低; ③粘度降低; ④生物功能丧失或改变。
加热DNA溶液使260nm紫外光的吸光度突然增加并达到最大值一半时的温度就是DNA变性温度(熔解温度,Tm)。 Tm的高低与DNA分子中G+C的含量有关。 G+C含量越高,Tm越高。
11. DNA复性和分子杂交:
使变性的 DNA 退火以重新形成双螺旋结构的过程称为 DNA 复性。
两条来源不同的单链核酸(DNA或RNA),只要具有大致相同的互补碱基序列,都可以通过退火退火形成新的杂合双螺旋。这种现象称为核酸分子杂交。核酸杂交可以是DNA-DNA或DNA-RNA杂交。来自不同来源的具有大致相同互补碱基序列的核酸片段称为同源序列。
常用的核酸分子杂交技术包括原位杂交、点杂交、Southern杂交和Northern杂交。
在核酸杂交分析过程中,已知序列的核酸片段常被放射性同位素或生物素标记,这种带有某些标记的已知序列的核酸片段称为探针。
12.核酸酶:
任何能水解核酸的酶都称为核酸酶。能水解多核苷酸链末端的核酸的酶称为核酸外切酶,能水解多核苷酸链中间的核酸的酶称为核酸内切酶。能识别特定核苷酸序列并从特定位点水解核酸的核酸内切酶称为限制性核酸内切酶(restrictionase)
第 4 章酶
1、酶的概念:
酶是由活细胞产生的生物催化剂,具有极高的催化效率和高度的底物特异性,其化学性质为蛋白质。酶按其分子结构可分为三类:单体酶、寡聚酶和多酶系统(多酶复合物和多功能酶)。
2、酶的分子组成:
酶分子按其化学成分可分为简单酶和共轭酶(全酶)。结合酶由酶蛋白和辅因子两部分组成。酶蛋白部分主要与酶的底物特异性有关,辅因子与酶的催化活性有关。
与酶蛋白松散结合并与酶的催化活性有关的耐热低分子有机化合物称为辅酶。与酶蛋白牢固结合并与酶的催化活性有关的耐热低分子有机化合物称为辅基。
3、辅酶和辅基的来源及其生理功能:
辅酶和辅基的主要生理功能是:(1)携带氢原子或电子,参与氧化还原反应。 (2)携带活性基团,如酰基、氨基、烷基、羧基和一碳单元等,参与基团转移。大多数辅酶和辅酶基团来源于维生素。
维生素是指维持细胞正常功能所必需的一类小分子有机化合物,但在许多生物体内不能自行合成,必须由食物提供。
维生素按溶解度可分为脂溶性维生素和水溶性维生素。脂溶性维生素包括VitA、VitD、VitE和VitK;水溶性维生素包括VitB1、VitB2、VitPP、VitB6、VitB12、VitC、泛酸、生物素、叶酸等。
1.TPP:硫胺素焦磷酸,由硫胺素(Vit B1)焦磷酸化生成,是脱羧酶的辅酶,在体内糖代谢过程中参与α-酮酸的氧化脱羧。
2.FMN和FAD:即黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD),它们是核黄素(VitB2)的衍生物。 FMN 或 FAD 通常用作脱氢酶的辅基,并在酶促反应中用作氢转移剂(双氢转移剂)。
3.NAD+和NADP+:即烟酰胺腺嘌呤二核苷酸(NAD+,辅酶I)和烟酰胺腺嘌呤二核苷酸磷酸(NADP+,辅酶II),它们是Vit PP的衍生物。 NAD+和NADP+主要用作脱氢酶的辅酶,在酶促反应中起氢转移体的作用,是单一的氢转移体。
4、磷酸吡哆醛和磷酸吡哆胺:维生素 B6 的衍生物。磷酸吡哆醛和磷酸吡哆胺可用作转氨酶、氨基酸脱羧酶、半胱氨酸脱硫酶等的辅酶。
5.CoA:泛酸(pantothenic acid)参与体内辅酶A(CoA)的形成。 CoA中的巯基可以通过高能硫酯键与羧基结合,在糖、脂和蛋白质的代谢中起转移酰基的作用,是酰基转移酶的辅酶。
6、生物素:是羧化酶的辅基,参与体内CO2的固定和羧化。
7、 FH4:衍生自叶酸。四氢叶酸是体内单碳单元基团转移酶系统中的一种辅酶。
8、维生素B12衍生物:维生素B12分子中含有金属元素钴,故又称钴胺素。 Vit B12在体内具有多种活性形式,如5'-脱氧腺苷钴胺素、甲钴胺素等。其中,5'-脱氧腺苷钴胺素参与变位酶辅酶的形成,甲钴胺是甲基转移酶的辅酶。
4、金属离子的作用:
1、稳定构象:稳定酶蛋白催化活性所必需的分子构象;
2、构成酶活性中心:作为酶活性中心的组成部分,参与酶活性中心的形成;
3、连接:作为桥梁,底物分子与酶蛋白螯合。
5、酶的活性中心:
酶分子上具有一定空间构象的位点,化学基团集中并直接参与将底物转化为产物的反应过程,该位点称为酶的活性中心。
参与酶活性中心形成的化学基团,有的与底物结合,称为结合基团,有的通过底物的反应催化成产物,称为催化基团,这两类群 群统称为活动中心的基本群。除了酶的活性中心外,还有一些化学基团,主要与维持酶的空间构象有关,称为酶活性中心之外的必需基团。
6、酶促反应特点:
1、具有极高的催化效率:酶的催化效率可比普通催化剂提高106~1020倍。酶可以与底物形成ES中间体配合物,从而改变化学反应的过程,大大降低反应所需的活化能阈值,大大增加活化分子的数量,从而加速反应。
2、具有高度的底物特异性:一种酶只作用于一种或一类化合物,以促进某种化学变化并产生某种产物。这种现象称为酶作用的特异性。
⑴绝对特异性:一种酶只能作用于一种化合物催化化学反应,称为绝对特异性,如琥珀酸脱氢酶。
2 相对特异性:一种酶只能作用于一种化合物或一种化学键来催化一种化学反应,称为相对特异性,如脂肪酶。
3 立体特异性:一种酶只能作用于一种立体异构体,或者只能产生一种立体异构体,称为立体特异性,如L-精氨酸酶。
3、酶的催化活性是可以调节的:例如代谢物可以调节酶的催化活性,酶分子的共价修饰可以改变酶的催化活性,也可以通过改变合成来改变催化活性of the enzyme protein.
7、 Mechanism of enzymatic reaction:
1、 The intermediate complex theory and the induction fit theory: when the enzyme is catalyzed, the enzyme active center first combines with the substrate to form an enzyme-substrate complex (ES), which is then decomposed to release the enzyme and generate a product, which is an intermediate complex. complex theory. When the substrate is close to the enzyme,
Substrate molecules can induce the conformation of the active center of the enzyme to change, making it a conformation that can be closely combined with the substrate molecule, which is the theory of induced fit.
2、 Factors related to the high-efficiency catalysis of enzymes: ① proximity effect and orientation effect; ② tension effect; ③ acid-base catalysis; ④ covalent catalysis; ⑤ low dielectric region (surface effect) of enzyme active center.
8、 Kinetics of enzymatic reaction:
Enzyme kinetics mainly studies the reaction rate catalyzed by enzymes and various factors that affect the reaction rate. When discussing the influence of various factors on the rate of enzymatic reaction, the initial rate is usually measured to represent the rate of enzymatic reaction, that is, the rate of reaction when the amount of substrate conversion is less than 5%.
1、 The effect of substrate concentration on the reaction rate:
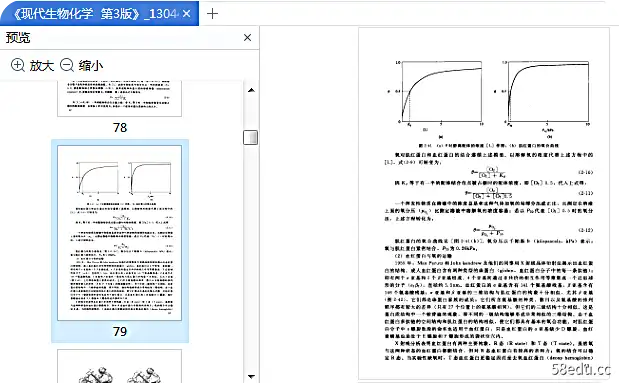
⑴Substrate saturation of enzymatic reaction: It is observed from experiments that when the enzyme concentration is constant, the relationship between different substrate concentrations and reaction speed is a rectangular hyperbola, that is, when the substrate concentration is low , the increase in reaction rate is proportional to the increase in substrate concentration (first-order reaction); after that,
With the increase of the substrate concentration, the increase of the reaction speed gradually decreases (mixed-stage reaction); finally, when the substrate concentration increases to a certain amount, the reaction speed reaches a maximum value, and no longer increases with the increase of the substrate concentration while increasing (zero-order reaction).
(2) Michaelis equation and Michaelis constant: According to the above experimental results, Michaelis & Menten deduced the mathematical expression of the above rectangular hyperbola in 1913, namely the Michaelis equation: ν= Vmax[S]/(Km+[ S]). Among them, Vmax is the maximum reaction speed, and Km is the Michaelis constant.
The significance of CDKm and Vmax:
①When ν=Vmax/2, Km=[S]. Therefore, Km is equal to the substrate concentration at which the rate of the enzymatic reaction reaches half the maximum value.
②When k-1>>k+2, Km=k-1/k+1=Ks. Therefore, Km can reflect the affinity between the enzyme and the substrate, that is, the smaller the Km value, the greater the affinity between the enzyme and the substrate;否则,越小。
③Km can be used to judge the order of the reaction: when [S]<0.01Km, ν=(Vmax/Km)[S], the reaction is a first-order reaction, that is, the reaction speed is proportional to the concentration of the substrate; when [S] ]>100Km, ν=Vmax, the reaction is zero-order reaction, that is, the reaction speed has nothing to do with the substrate concentration; when 0.01Km<[S]<100Km, the reaction is between the zero-order reaction and the first-order reaction, which is a mixed-order reaction reaction.
④Km is the characteristic constant of the enzyme: under certain conditions, the Km value of a certain enzyme is constant, so it can be judged by measuring the Km value of different enzymes (especially a group of isoenzymes) whether it is different enzyme.
⑤Km can be used to determine the optimum substrate for the enzyme: when the enzyme has several different substrates, the one with the smallest Km value is the optimum substrate for the enzyme.
⑥Km can be used to determine the substrate concentration required for the determination of enzyme activity: when [S]=10Km, ν=91% Vmax, which is the most suitable substrate concentration required for the determination of enzyme activity.
⑦Vmax can be used to calculate the turnover number of the enzyme: when the total concentration of the enzyme and the maximum speed are known, the turnover number of the enzyme can be calculated, that is, the number of molecules that each enzyme molecule catalyzes the conversion of the substrate to the product per unit time. .
⑷ Determination of Km and Vmax: Mainly using Lineweaver-Burk double reciprocal plotting method and Hanes plotting method.
2、 The effect of enzyme concentration on the reaction speed: When the concentration of the substrate in the reaction system is large enough, the enzymatic reaction speed is proportional to the enzyme concentration, that is, ν=k[E].
3、 The effect of temperature on the reaction speed: Generally speaking, the enzymatic reaction speed increases with the increase of temperature, but when the temperature increases to a certain point, the reaction speed decreases rapidly due to the thermal denaturation of the enzyme protein. The temperature at which the rate of enzymatic reaction reaches a maximum value with the increase of temperature is called the optimum temperature of the enzyme.
The optimum temperature of the enzyme is related to the experimental conditions, so it is not a characteristic constant of the enzyme. When the temperature is low, the number of activated molecules decreases, and the reaction rate decreases, but when the temperature increases, the enzyme activity can be restored.
4、 The effect of pH on the reaction rate: Observe the effect of pH on the rate of enzymatic reaction, usually a bell-shaped curve, that is, too high or too low pH can lead to a decrease in the catalytic activity of the enzyme. The pH value of the solution when the catalytic activity of the enzyme is the highest is called the optimum pH of the enzyme. The optimum pH of most enzymes in the human body is between 6.5 and 8.0. The optimum pH of an enzyme is not a constant characteristic of an enzyme.
5、 The effect of inhibitor on reaction rate:
Substances that can reduce the rate of enzymatic reaction but do not cause denaturation and inactivation of enzyme molecules are collectively referred to as enzyme inhibitors. According to the inhibitory effect of the inhibitor, it can be divided into two categories: irreversible inhibition and reversible inhibition.
⑴Irreversible inhibition:
The covalent binding of the inhibitor to the essential group of the enzyme molecule causes the inhibition of the enzyme activity, and the inhibition effect that cannot be recovered by simple methods such as dialysis is irreversible inhibition. If ν~[E] is plotted, a set of parallel lines with the same slope can be obtained, which move parallel to the right with increasing inhibitor concentration.
Irreversible inhibition of enzymes includes specific inhibition (such as the inhibition of cholinesterase by organophosphorus pesticides) and non-specific inhibition (such as the inhibition of thiolase by Lewis gas).
(2) Reversible inhibition:
Reversible binding of the inhibitor to the enzyme molecule by non-covalent bond results in the inhibition of the enzyme activity, and the inhibitor can be removed by simple methods such as dialysis and the enzyme activity can be completely restored. The inhibitory effect is reversible inhibition. If plotted against ν ~ [E], a set of straight lines with decreasing slope with increasing inhibitor concentration can be obtained.
Reversible inhibition includes several types of competitive, anti-competitive and non-competitive inhibition.
①Competitive inhibition: The inhibitor competes with the substrate to bind to the same active center of the enzyme, thereby interfering with the binding between the enzyme and the substrate, and reducing the catalytic activity of the enzyme. This effect is called competitive inhibition. Its characteristics are: a. Competitive inhibitors are often enzyme substrate analogs or reaction products;
b. The binding site of the inhibitor and the enzyme is the same as the binding site of the substrate and the enzyme; C。 The greater the inhibitor concentration, the greater the inhibitory effect; but increasing the substrate concentration can reduce the degree of inhibition; d。 Kinetic parameters: Km value increases, Vm value does not change.
Typical examples are the competitive inhibition of malonate-p-succinate dehydrogenase (substrate is succinate) and sulfonamides (p-aminobenzenesulfonamide) p-dihydrofolate synthase (substrate is p-amino) Competitive inhibition of benzoic acid).
2 Anti-competitive inhibition: The inhibitor cannot bind to the free enzyme, but can bind to the ES complex and prevent the formation of the product, reducing the catalytic activity of the enzyme, which is called anti-competitive inhibition of the enzyme. Its characteristics are: a. The inhibitor and the substrate can bind to different parts of the enzyme at the same time;湾。 The substrate must exist,
Inhibitors can inhibit the enzyme; C。 Kinetic parameters: Km decreases, Vm decreases.
③ Non-competitive inhibition: The inhibitor can bind to either free enzyme or ES complex to reduce the catalytic activity of the enzyme, which is called non-competitive inhibition. Its characteristics are: a. The substrate and the inhibitor bind to different parts of the enzyme independently;湾。 The inhibitor has no effect on the binding between the enzyme and the substrate,
Therefore, the change of substrate concentration has no effect on the degree of inhibition; C。 Kinetic parameters: Km value remains unchanged, Vm value decreases.
6、 The effect of activators on reaction speed: Substances that can promote the speed of enzymatic reactions are called activators of enzymes. Most of the enzyme activators are metal ions, such as K+, Mg2+, Mn2+, etc. The activator of salivary amylase is Cl-.
9。 Enzyme regulation:
Enzymes that can change the speed or direction of the entire metabolic reaction by changing their catalytic activity are called rate-limiting enzymes or key enzymes.
酶活性的调节可以通过改变其结构而使其催化活性以生改变,也可以通过改变其含量来改变其催化活性,还可以通过以不同形式的酶在不同组织中的分布差异来调节代谢活动。
1.酶结构的调节:通过对现有酶分子结构的影响来改变酶的催化活性。这是一种快速调节方式。
⑴变构调节:又称别构调节。某些代谢物能与变构酶分子上的变构部位特异性结合,使酶的分子构发生改变,从而改变酶的催化活性以及代谢反应的速度,这种调节作用就称为变构调节。具有变构调节作用的酶就称为变构酶。
凡能使酶分子变构并使酶的催化活性发生改变的代谢物就称为变构剂。当变构酶的一个亚基与其配体(底物或变构剂)结合后,能够通过改变相邻亚基的构象而使其对配体的亲和力发生改变,这种效应就称为变构酶的协同效应。变构剂一般以反馈方式对代谢途径的起始关键酶进行调节,
常见的为负反馈调节。变构调节的特点:① 酶活性的改变通过酶分子构象的改变而实现;②酶的变构仅涉及非共价键的变化;③调节酶活性的因素为代谢物;④为一非耗能过程;⑤无放大效应。
⑵共价修饰调节:酶蛋白分子中的某些基团可以在其他酶的催化下发生共价修饰,从而导致酶活性的改变,称为共价修饰调节。共价修饰方式有:磷酸化-脱磷酸化等。共价修饰调节一般与激素的调节相联系,其调节方式为级联反应。
共价修饰调节的特点为:①酶以两种不同修饰和不同活性的形式存在;②有共价键的变化;③受其他调节因素(如激素)的影响;④一般为耗能过程;⑤存在放大效应。
⑶酶原的激活:处于无活性状态的酶的前身物质就称为酶原。酶原在一定条件下转化为有活性的酶的过程称为酶原的激活。酶原的激活过程通常伴有酶蛋白一级结构的改变。酶原分子一级结构的改变导致了酶原分子空间结构的改变,
使催化活性中心得以形成,故使其从无活性的酶原形式转变为有活性的酶。酶原激活的生理意义在于:保护自身组织细胞不被酶水解消化。
2.酶含量的调节:是指通过改变细胞中酶蛋白合成或降解的速度来调节酶分子的绝对含量,影响其催化活性,从而调节代谢反应的速度。这是机体内迟缓调节的重要方式。
⑴酶蛋白合成的调节:酶蛋白的合成速度通常通过一些诱导剂或阻遏剂来进行调节。凡能促使基因转录增强,从而使酶蛋白合成增加的物质就称为诱导剂;反之,则称为阻遏剂。常见的诱导剂或阻遏剂包括代谢物、药物和激素等。
⑵酶蛋白降解的调节:如饥饿时,精氨酸酶降解减慢,故酶活性增高,有利于氨基酸的分解供能。
3.同工酶的调节:在同一种属中,催化活性相同而酶蛋白的分子结构,理化性质及免疫学性质不同的一组酶称为同工酶。同工酶在体内的生理意义主要在于适应不同组织或不同细胞器在代谢上的不同需要。因此,同工酶在体内的生理功能是不同的。
乳酸脱氢酶同工酶(LDHs)为四聚体,在体内共有五种分子形式,即LDH1(H4),LDH2(H3M1),LDH3(H2M2),LDH4(H1M3)和LDH5(M4)。心肌中以LDH1含量最多,LDH1对乳酸的亲和力较高,
因此它的主要作用是催化乳酸转变为丙酮酸再进一步氧化分解,以供应心肌的能量。在骨骼肌中含量最多的是LDH5,LDH5对丙酮酸的亲和力较高,因此它的主要作用是催化丙酮酸转变为乳酸,以促进糖酵解的进行。
十、酶的命名与分类:
1.酶的命名:主要有习惯命名法与系统命名法两种,但常用者为习惯命名法。
2.酶的分类:根据1961年国际酶学委员会(IEC)的分类法,将酶分为六大类:① 氧化还原酶类:催化氧化还原反应;②转移酶类:催化一个基团从某种化合物至另一种化合物;③水解酶类:催化化合物的水解反应;④裂合酶类:
催化从双键上去掉一个基团或加上一个基团至双键上;⑤异构酶类:催化分子内基团重排;⑥合成酶类:催化两分子化合物的缔合反应。――――――――――
第五章 糖代谢
1、糖类的生理功用:
① 氧化供能:糖类是人体最主要的供能物质,占全部供能物质供能量的70%;与供能有关的糖类主要是葡萄糖和糖原,前者为运输和供能形式,后者为贮存形式。
② 作为结构成分:糖类可与脂类形成糖脂,或与蛋白质形成糖蛋白,糖脂和糖蛋白均可参与构成生物膜、神经组织等。
③作为核酸类化合物的成分:核糖和脱氧核糖参与构成核苷酸,DNA,RNA等。
④转变为其他物质:糖类可经代谢而转变为脂肪或氨基酸等化合物。
2、糖的无氧酵解:
糖的无氧酵解是指葡萄糖在无氧条件下分解生成乳酸并释放出能量的过程。其全部反应过程在胞液中进行,代谢的终产物为乳酸,一分子葡萄糖经无氧酵解可净生成两分子ATP。
糖的无氧酵解代谢过程可分为四个阶段:
1、活化(己糖磷酸酯的生成):葡萄糖经磷酸化和异构反应生成1,6-双磷酸果糖(FBP),即葡萄糖→6-磷酸葡萄糖→6-磷酸果糖→1,6-双磷酸果糖(F-1,6-BP)。这一阶段需消耗两分子ATP,己糖激酶(肝中为葡萄糖激酶)和6-磷酸果糖激酶-1是关键酶。
2、裂解(磷酸丙糖的生成):一分子F-1,6-BP裂解为两分子3-磷酸甘油醛,包括两步反应:F-1,6-BP→磷酸二羟丙酮 + 3-磷酸甘油醛 和磷酸二羟丙酮→3-磷酸甘油醛。
3、放能(丙酮酸的生成):3-磷酸甘油醛经脱氢、磷酸化、脱水及放能等反应生成丙酮酸,包括五步反应:3-磷酸甘油醛→1,3-二磷酸甘油酸→3-磷酸甘油酸→2-磷酸甘油酸→磷酸烯醇式丙酮酸→丙酮酸。此阶段有两次底物水平磷酸化的放能反应,
共可生成2×2=4分子ATP。丙酮酸激酶为关键酶。
4.还原(乳酸的生成):利用丙酮酸接受酵解代谢过程中产生的NADH,使NADH重新氧化为NAD+。即丙酮酸→乳酸。
3、糖无氧酵解的调节:
主要是对三个关键酶,即己糖激酶(葡萄糖激酶)、6-磷酸果糖激酶-1、丙酮酸激酶进行调节。己糖激酶的变构抑制剂是G-6-P;肝中的葡萄糖激酶是调节肝细胞对葡萄糖吸收的主要因素,受长链脂酰CoA的反馈抑制;
6-磷酸果糖激酶-1是调节糖酵解代谢途径流量的主要因素,受ATP和柠檬酸的变构抑制,AMP、ADP、1,6-双磷酸果糖和2,6-双磷酸果糖的变构激活;丙酮酸激酶受1,6-双磷酸果糖的变构激活,受ATP的变构抑制,肝中还受到丙氨酸的变构抑制。
4、糖无氧酵解的生理意义:
1、在无氧和缺氧条件下,作为糖分解供能的补充途径:⑴ 骨骼肌在剧烈运动时的相对缺氧;⑵ 从平原进入高原初期;⑶ 严重贫血、大量失血、呼吸障碍、肺及心血管疾患所致缺氧。
2、在有氧条件下,作为某些组织细胞主要的供能途径:如表皮细胞,红细胞及视网膜等,由于无线粒体,故只能通过无氧酵解供能。
5、糖的有氧氧化:
葡萄糖在有氧条件下彻底氧化分解生成C2O和H2O,并释放出大量能量的过程称为糖的有氧氧化。绝大多数组织细胞通过糖的有氧氧化途径获得能量。此代谢过程在细胞胞液和线粒体内进行,
一分子葡萄糖彻底氧化分解可产生36/38分子ATP。糖的有氧氧化代谢途径可分为三个阶段:
1.葡萄糖经酵解途径生成丙酮酸:
此阶段在细胞胞液中进行,与糖的无氧酵解途径相同,涉及的关键酶也相同。一分子葡萄糖分解后生成两分子丙酮酸,两分子(NADH+H+)并净生成2分子ATP。 NADH在有氧条件下可进入线粒体产能,共可得到2×2或2×3分子ATP。故第一阶段可净生成6/8分子ATP。
2.丙酮酸氧化脱羧生成乙酰CoA:
丙酮酸进入线粒体,在丙酮酸脱氢酶系的催化下氧化脱羧生成(NADH+H+)和乙酰CoA。此阶段可由两分子(NADH+H+)
产生2×3分子ATP 。丙酮酸脱氢酶系为关键酶,该酶由三种酶单体构成,涉及六种辅助因子,即NAD+、FAD、CoA、TPP、硫辛酸和Mg2+。
3.经三羧酸循环彻底氧化分解:
生成的乙酰CoA可进入三羧酸循环彻底氧化分解为CO2和H2O,并释放能量合成ATP。一分子乙酰CoA氧化分解后共可生成12分子ATP,故此阶段可生成2×12=24分子ATP。
三羧酸循环是指在线粒体中,乙酰CoA首先与草酰乙酸缩合生成柠檬酸,然后经过一系列的代谢反应,乙酰基被氧化分解,而草酰乙酸再生的循环反应过程。这一循环反应过程又称为柠檬酸循环或Krebs循环。
三羧酸循环由八步反应构成:草酰乙酸 + 乙酰CoA→柠檬酸→异柠檬酸→α-酮戊二酸→琥珀酰CoA→琥珀酸→延胡索酸→苹果酸→草酰乙酸。
三羧酸循环的特点:
①循环反应在线粒体中进行,为不可逆反应。
②每完成一次循环,氧化分解掉一分子乙酰基,可生成12分子ATP。
③循环的中间产物既不能通过此循环反应生成,也不被此循环反应所消耗。
④循环中有两次脱羧反应,生成两分子CO2、
⑤循环中有四次脱氢反应,生成三分子NADH和一分子FADH2、
⑥循环中有一次直接产能反应,生成一分子GTP。
⑦三羧酸循环的关键酶是柠檬酸合酶、异柠檬酸脱氢酶和α-酮戊二酸脱氢酶系,且α-酮戊二酸脱氢酶系的结构与丙酮酸脱氢酶系相似,辅助因子完全相同。
6、糖有氧氧化的生理意义:
1.是糖在体内分解供能的主要途径:⑴ 生成的ATP数目远远多于糖的无氧酵解生成的ATP数目;⑵ 机体内大多数组织细胞均通过此途径氧化供能。
2.是糖、脂、蛋白质氧化供能的共同途径:糖、脂、蛋白质的分解产物主要经此途径彻底氧化分解供能。
3.是糖、脂、蛋白质相互转变的枢纽:有氧氧化途径中的中间代谢物可以由糖、脂、蛋白质分解产生,某些中间代谢物也可以由此途径逆行而相互转变。
7、有氧氧化的调节和巴斯德效应:
丙酮酸脱氢酶系受乙酰CoA、ATP和NADH的变构抑制,受AMP、ADP和NAD+的变构激活。异柠檬酸脱氢酶是调节三羧酸循环流量的主要因素,ATP是其变构抑制剂,AMP和ADP是其变构激活剂。
巴斯德效应:糖的有氧氧化可以抑制糖的无氧酵解的现象。有氧时,由于酵解产生的NADH和丙酮酸进入线粒体而产能,故糖的无氧酵解受抑制。
8、磷酸戊糖途径:
磷酸戊糖途径是指从G-6-P脱氢反应开始,经一系列代谢反应生成磷酸戊糖等中间代谢物,然后再重新进入糖氧化分解代谢途径的一条旁路代谢途径。该旁路途径的起始物是G-6-P,返回的代谢产物是3-磷酸甘油醛和6-磷酸果糖,
其重要的中间代谢产物是5-磷酸核糖和NADPH。整个代谢途径在胞液中进行。关键酶是6-磷酸葡萄糖脱氢酶。
9、磷酸戊糖途径的生理意义:
是体内生成NADPH的主要代谢途径:NADPH在体内可用于:⑴ 作为供氢体,参与体内的合成代谢:如参与合成脂肪酸、胆固醇等。 ⑵ 参与羟化反应:作为加单氧酶的辅酶,参与对代谢物的羟化。 ⑶ 维持巯基酶的活性。
⑷ 使氧化型谷胱甘肽还原。 ⑸ 维持红细胞膜的完整性:由于6-磷酸葡萄糖脱氢酶遗传性缺陷可导致蚕豆病,表现为溶血性贫血。
2、是体内生成5-磷酸核糖的唯一代谢途径:体内合成核苷酸和核酸所需的核糖或脱氧核糖均以5-磷酸核糖的形式提供,其生成方式可以由G-6-P脱氢脱羧生成,也可以由3-磷酸甘油醛和F-6-P经基团转移的逆反应生成。
十、糖原的合成与分解:
糖原是由许多葡萄糖分子聚合而成的带有分支的高分子多糖类化合物。糖原分子的直链部分借α-1,4-糖苷键而将葡萄糖残基连接起来,其支链部分则是借α-1,6-糖苷键而形成分支。糖原是一种无还原性的多糖。糖原的合成与分解代谢主要发生在肝、肾和肌肉组织细胞的胞液中。
1.糖原的合成代谢:糖原合成的反应过程可分为三个阶段。
⑴活化:由葡萄糖生成尿苷二磷酸葡萄糖:葡萄糖→6-磷酸葡萄糖→1-磷酸葡萄糖→UDPG。此阶段需使用UTP,并消耗相当于两分子的ATP。
⑵缩合:在糖原合酶催化下,UDPG所带的葡萄糖残基通过α-1,4-糖苷键与原有糖原分子的非还原端相连,使糖链延长。糖原合酶是糖原合成的关键酶。
⑶分支:当直链长度达12个葡萄糖残基以上时,在分支酶的催化下,将距末端6~7个葡萄糖残基组成的寡糖链由α-1,4-糖苷键转变为α-1,6-糖苷键,使糖原出现分支,同时非还原端增加。
2.糖原的分解代谢:糖原的分解代谢可分为三个阶段,是一非耗能过程。
⑴水解:糖原→1-磷酸葡萄糖。此阶段的关键酶是糖原磷酸化酶,并需脱支酶协助。
⑵异构:1-磷酸葡萄糖→6-磷酸葡萄糖。
⑶脱磷酸:6-磷酸葡萄糖→葡萄糖。此过程只能在肝和肾进行。
十1、糖原合成与分解的生理意义:
1.贮存能量:葡萄糖可以糖原的形式贮存。
2.调节血糖浓度:血糖浓度高时可合成糖原,浓度低时可分解糖原来补充血糖。
3.利用乳酸:肝中可经糖异生途径利用糖无氧酵解产生的乳酸来合成糖原。这就是肝糖原合成的三碳途径或间接途径。
十2、糖异生:
由非糖物质转变为葡萄糖或糖原的过程称为糖异生。该代谢途径主要存在于肝及肾中。糖异生主要沿酵解途径逆行,但由于有三步反应(己糖激酶、磷酸果糖激酶-1、丙酮酸激酶)为不可逆反应,故需经另外的反应绕行。
1、 G-6-P → G:由葡萄糖-6-磷酸酶催化进行水解,该酶是糖异生的关键酶之一,不存在于肌肉组织中,故肌肉组织不能生成自由葡萄糖。
2、 F-1,6-BP → F-6-P:由果糖1,6-二磷酸酶-1催化进行水解,该酶也是糖异生的关键酶之一。
3.丙酮酸 → 磷酸烯醇式丙酮酸:经由丙酮酸羧化支路完成,即丙酮酸进入线粒体,在丙酮酸羧化酶(需生物素)的催化下生成草酰乙酸,后者转变为苹果酸穿出线粒体并回复为草酰乙酸,再在磷酸烯醇式丙酮酸羧激酶的催化下转变为磷酸烯醇式丙酮酸,这两个酶都是关键酶。
糖异生的原料主要来自于生糖氨基酸、甘油和乳酸。
十3、糖异生的生理意义:
1.在饥饿情况下维持血糖浓度的相对恒定:在较长时间饥饿的情况下,机体需要靠糖异生作用生成葡萄糖以维持血糖浓度的相对恒定。
2.回收乳酸分子中的能量:由于乳酸主要是在肌肉组织经糖的无氧酵解产生,但肌肉组织糖异生作用很弱,且不能生成自由葡萄糖,故需将产生的乳酸转运至肝脏重新生成葡萄糖后再加以利用。
葡萄糖在肌肉组织中经糖的无氧酵解产生的乳酸,可经血循环转运至肝脏,再经糖的异生作用生成自由葡萄糖后转运至肌肉组织加以利用,这一循环过程就称为乳酸循环(Cori循环)。
3.维持酸碱平衡:肾脏中生成的α-酮戊二酸可转变为草酰乙酸,然后经糖异生途径生成葡萄糖,这一过程可促进肾脏中的谷氨酰胺脱氨基,生成NH3,后者可用于中和H+,故有利于维持酸碱平衡。
十4、血糖:
血液中的葡萄糖含量称为血糖。按真糖法测定,正常空腹血糖浓度为3.89~6.11mmol/L(70~100mg%)。
1.血糖的来源与去路:正常情况下,血糖浓度的相对恒定是由其来源与去路两方面的动态平衡所决定的。血糖的主要来源有:① 消化吸收的葡萄糖;② 肝脏的糖异生作用;③ 肝糖原的分解。血糖的主要去路有:
① 氧化分解供能;② 合成糖原(肝、肌、肾);③ 转变为脂肪或氨基酸;④ 转变为其他糖类物质。
2.血糖水平的调节:调节血糖浓度相对恒定的机制有:
⑴组织器官:①肝脏:通过加快将血中的葡萄糖转运入肝细胞,以及通过促进肝糖原的合成,以降低血糖浓度;通过促进肝糖原的分解,以及促进糖的异生作用,以增高血糖浓度。 ②肌肉等外周组织:通过促进其对葡萄糖的氧化利用以降低血糖浓度。
⑵激素:①降低血糖浓度的激素――胰岛素。 ②升高血糖浓度的激素――胰高血糖素、肾上腺素、糖皮质激素、生长激素、甲状腺激素。
⑶神经系统。
现代生物科学专业介绍
1、专业定义:
生物科学(又称生命科学)专业包括了生物科学和生物技术两个专业方向,这些专业学科主要培养学生学习生物科学技术方面的基本理论、基本知识,学生将受到应用基础研究和技术开发方面的科学思维和科学实验训练,
进而具有较好的科学素养及初步的教学、研究、开发与管理的基本能力。其核心课程主要包括了动物生物学、植物生物学、微生物学、生物化学、遗传学、细胞生物学、分子生物学、生态学、植物生理学、人体组织解剖学等学科;
必修课程则包括无机及分析化学、有机化学、高等数学、遗传学、免疫学、发育生物学、生物化学、生物统计学、生物技术概论。
2、主干课程:
动物生物学、植物生物学、微生物学、生物化学、细胞生物学、遗传学、发育生物学、神经生物学、分子生物学、生态学等。
主干学科:生物学、医学、农学、计算机科学与技术。
核心知识领域:生命的化学分子基础、细胞的结构与功能及其重要生命活动、动物体的结构 与功能、植物体的结构与功能、微生物的特征与代谢、生物多样性与进化、生物与环境。
3、培养目标
本专业培养具备生物学基础理论、基本知识和基本技能,具有数理化基础、人文社 科素质、国际化视野和科学思维能力,接受专业理论和专业技能训练,并能运用所掌握的理论知识和技能在生物学及相关领域从事科学研究、技术开发、教学及管理等方面工作的创新型人才。
4、设置背景
生物科学专业培养具备生物科学的基本理论、基本知识和较强的实验技能,能在科研机构、高等学校及企事业单位等从事科学研究、教学工作及管理工作的生物科学高级专门人才。
学生主要学习生物科学方面的基本理论、基本知识,受到基础研究和应用基础研究方面的科学思维和科学实验训练,具有较好的科学素养及一定的教学、科研能力。
5、知识技能
1.掌握数理化等方面的基本理论和基本知识;
2.掌握扎实的学科基础课程、专业必修课程、选修课程的基础理论和基本知识,掌握扎实、宽厚的生物科学基础知识和基本理论;
3.熟练掌握生物科学基本实验技术以及相关的实验设计、开展、实施和分析的相关技能,了解并实践获取知识和创新的基本方法、技能和过程;
4.掌握资料查询、文献检索及运用现代信息技术获取相关信息的基本方法;
4.掌握归纳、整理、分析实验结果的方法,撰写论文,并具有参与学术报告交流的能力;
5.了解生物科学及交叉学科理论前沿知识和应用前景;
6.了解国家科技政策、知识产权等有关政策和法规。
6、研究领域
生物科学专业研究对象由生物科学家根据生物的发展历史、形态结构特征、营养方式以及它们在生态系统中的作用等,将生物分为若干界。当前比较通行的是美国R.H.惠特克于1969年提出的5界系统。他将细菌、
蓝菌等原核生物划为原核生物界,将单细胞的真核生物划为原生生物界,将多细胞的真核生物按营养方式划分为营光合自养的植物界、营吸收异养的真菌界和营吞食异养的动物界。中国生物科学家陈世骧于1979年提出6界系统。
这个系统由非细胞总界、原核总界和真核总界3个总界组成,代表生物进化的3个阶段。非细胞总界中只有1界,即病毒界。原核总界分为细菌界和蓝菌界。真核总界包括植物界、真菌界和动物界,它们代表真核生物进化的3条主要路线。
7、发展前景
本专业对于毕业生的专业知识和专业技能要求严格。毕业生主要在科研机构、科研院所、高等院校以及国家机关等部门继续从事科研、教学和高级管理工作。
8、相近专业:生物信息学、生物信息技术、生物科学与生物技术、动植物检疫、生物化学与分子生物学、医学信息学、植物生物技术、动物生物技术、生物工程、生物安全、生物制药工程、生物医学工程、生物制药、食品质量与安全。


